Егоров О.Е.*, Евзиков Г.Ю.*, Тимошенков А.В.*, Горбачева Ю.В.*, Баранова О.В.*, Пальцева Е.М., Шишкина Л.В.**
Множественные метастазы глиосаркомы головного мозга в корешки конского хвоста (клиническое наблюдение и обзор литературы).
* Московская медицинская академия им. И.М. Сеченова.
** НИИ нейрохирургии им. Н.Н. Бурденко, г. Москва.
Резюме
В статье представлено клиническое наблюдение множественных метастазов глиосаркомы головного мозга в корешки конского хвоста. Клинические проявления поражения корешков конского хвоста возникли через 16 мес. после удаления глиосаркомы и проведенных после этого лучевой и химиотерапии. Ведущей жалобой у пациента являлись боли в спине с иррадиацией в ноги. При МРТ — исследовании были выявлены множественные мелкие опухоли корешков в проекции L2 – L3
позвонков. Признаков локального рецидива опухоли при контрольном КТ – исследовании головного мозга выявлено не было. Произведена операция — удаление множественных опухолей корешков конского хвоста. Операция позволила купировать болевой синдром. Иммуногистохимическое исследование препаратов от первой (головной мозг) и второй (корешки конского хвоста) операций показало единый иммунофенотип опухоли с экспрессией GFAP, S-100 и виментина в опухолевых клетках, что подтвердило предположение о метастатической природе опухолей корешков.
Смешанную мультиформную глиобластому и саркому впервые в 1895 году описал Heinrich Stroebe – патолог, работавший в университетском госпитале г. Фрайбург. Он опубликовал описание первичной опухоли центральной нервной системы, состоявшей из злокачественных глиальных клеток и мезенхимальных клеток (8, 14). Однако признание глиосаркомы, как отдельного самостоятельного неопластического процесса, было достигнуто только после работы, опубликованной Feigin и Rubenstein в 1955 году (6,8,14). В последней редакции классификации опухолей центральной нервной системы, принятой ВОЗ, глиосаркома рассматривается как отдельный подвид глиобластом. Для установления морфологического диагноза глиосаркома, опухоль должна состоять из 2-х злокачественных клеточных популяций – глиальной и мезенхимальной, а глиальная
2
клеточная популяция должна быть астроцитарной и удовлетворять всем критериям диагностики глиобластомы (3,8,9,17, 21,23).
До настоящего времени дискуссионным остается вопрос происхождения мезенхимальной порции глиосаркомы. Ранее предполагалось, что трансформирование клеток в гиперпластических кровеносных сосудах с формированием самостоятельного мезенхимального компонента происходит в уже существующей мультиформной глиобластоме (9, 16, 17, 18). Гистологически мезенхимальный компонент традиционно классифицировался как фибросаркома (9,16,18,19). Однако, последние генетические исследования доказывают моноклональное происхождение двух компонентов глиосаркомы. Reis et al. (24) показали, что глиосаркомы несут генетические изменения характерные для глиобластом: мутация гена p53, PTEN – мутации, гомозиготное удаление гена р16, амплификация СDK 4 и MDM2. Но в глиосаркомах не отмечается избыточной экспрессии эпидермального фактора роста (EGFR), что характерно для мультиформных глиобластом. Эти генетические альтерации одинаковы для саркоматозного и глиального компонентов опухоли и позволяют предполагать, что саркоматозный компонент, вероятно, представляет собой фенотипически измененные глиальные клетки, а не отдельный дополнительный неопластический процесс (2,3).
Морфологически области глиального и саркоматозного строения могут быть отделены друг от друга, а могут быть перемешаны. Объемное соотношение глиальной и мезенхимальной ткани в опухолях вариабельно. Могут преобладать как глиальные, так и мезенхимальные участки (16, 27, 28).
Микроскопически глиальный компонент глиосаркомы обладает всеми характерными признаками глиобластомы: выраженным клеточным полиморфизмом, большим количеством митозов, в том числе патологических, высокой пролиферативной активностью (индекс пролиферации при иммуногистохимическом (ИГХ) исследовании с антителами (АТ) к Кi 67 более 10%), выраженной пролиферацией сосудов микроциркуляторного русла, зонами некрозов (8). Глиальные клетки имеют тенденцию
быть более мелкими и имеют более пикнотические ядра, чем злокачественные мезенхимальные клетки (17), при ИГХ исследовании экспрессируют белки S 100 и GFAP (14).
Мезенхимальный компонент чаще всего по морфологической картине напоминает типичную фибросаркому с плотно расположенными длинными пучками веретеновидных клеток, с выраженными признаками тканевого и клеточного атипизма. Клетки обычно имеют неровные контуры и большие, более везикулярные ядра, по сравнению со злокачественными астроцитами, отмечается большое количество митозов, в том числе и
3
патологических. Характерна выраженная пролиферация сосудов. В некоторых случаях саркоматозный компонент имеет морфологическое строение злокачественной фиброзной гистиоцитомы, в нем могут встречаться участки миксоидного строения с рыхлым расположением клеток, в редких случаях – участки дальнейшей дифференцировки с образованием хрящевой, костной, мышечной и жировой ткани. Отличительными чертами мезенхимального компонента являются насыщенность ретикулином и отрицательная
ИГХ реакция с АТ к GFAP и S 100 протеину (10, 20, 22). Минимум одна сливная саркоматозная область, занимающая одно поле зрения, требуется для установки диагноза глиосаркома (11 — 15, 17, 19, 26).
Частота встречаемости глиосаркомы составляет 1,8% — 8% всех глиобластом (14,16). Они поражают височную долю в 44% наблюдений, теменную – в 28%, лобную – в 17%, затылочную – в 11% (9, 18). Все исследователи отмечают схожесть клинических проявлений и средней продолжительности жизни у больных с глиосаркомами и мультиформными глиобластомами, отсутствие значительных различий возраста и пола больных, оценки статуса больных по шкале Карновского на момент установки диагноза, локализации и размеров опухоли (9, 14, 16, 22, 23).
Учитывая неоднородность строения глиосарком, до настоящего времени отсутствуют нейровизуализационные критерии диагностики данной опухоли. Морфологически области глиоматозной и саркоматозной инфильтрации могут быть перемешаны, что обусловливает иррегулярность и чередование зон гипоинтенсивных и гиперинтенсивных МР-сигналов. Нейровизуализационные признаки преобладания глиоматозного
компонента заключаются в накоплении контрастного вещества по краям новообразования, что подразумевает периферический инвазивный рост опухоли с преобладанием пролиферативных процессов по периферии. В центре подобной опухоли имеет место тромбирование сосудов с очагами некрозов и кровоизлияний, что характерно для обычной глиобластомы. Равномерное накопление контрастного вещества свидетельствует о преимущественно мезенхимальном типе строения с макроскопически достаточно отчетливыми демаркационными границами с веществом мозга и плотной структурой опухоли напоминающей менингиому. В некоторых случаях глиосаркома может примыкать к твердой мозговой оболочке и даже врастать в нее. Это может привести к ошибочной трактовке опухоли при МРТ и КТ-исследовании, как образования мозговых оболочек. Даже макроскопически, в ходе хирургического вмешательства, подобная опухоль может приниматься хирургом за менингиому (16,18,25). В некоторых публикациях отмечено, что глиосаркомы с КТ или МРТ признаками менингиомы, то есть представленные в основном мезенхимальным компонентом, сопровождаются более
4
долгой продолжительностью жизни, чем преимущественно глиальные опухоли (соответственно 62 -71 и 53 — 63 недели после проведения хирургического лечения, лучевой и химиотерапии) (4, 26).
Лечебная тактика при глиосаркомах, как и при глиобластомах, предполагает проведение комбинированного лечения, включающего хирургическое вмешательство, лучевую и химиотерапию.
Исследования, в которых проводится сравнительная оценка эффективности лечения глиобластом и глиосарком немногочисленны. По результатам исследований создается впечатление о немного более благоприятном течении заболевания у пациентов с глиосаркомами. По данным Galanis (9) среднее время развития опухоли до клинической декомпенсации и средняя продолжительность жизни при глиосаркомах составляет соответственно 28 недель и 35,1 недель, при мультиформных глиобластомах аналогичные показатели – 16,7 и 34,4 недель. Средние сроки выживаемости после начала комплексного лечения при глиобластомах — 8,3, при глиосаркомах — 9,6 месяцев (17). Средние сроки выживаемости больных, получающих только лучевую терапию или лучевую и химиотерапию при глиобластомах – 33, при глиосаркомах — 36 недель (17,18). По данным J. Lutterbach (14) средняя продолжительность жизни для пациентов с глиосаркомой после хирургического лечения и лучевой терапии — 11,5 мес., а для пациентов с глиобластомой — 8,1 мес.
Глиосаркомы, как и прочие глиобластомы, в первую очередь склонны к локальному рецидивированию. В случае рецидивов повторный рост опухоли происходит, как правило, в стенке послеоперационной кисты, возникшей после удаления первичной опухоли. Возможно возникновение нового очага в перифокальной области. При первичном вовлечении в опухолевый процесс стенки желудочка, в случае продолженного роста, возможно более широкое перивентрикулярное распространение. Отдаленные метастазы при глиосаркомах встречаются редко, хотя в некоторых публикациях тенденция глиосарком к метастазированию предполагается более высокой, чем у глиобластом (14,29). В литературе описано около 20 наблюдений отдаленных (в том числе множественных) экстракраниальных метастазов глиосаркомы. Подобная выборка демонстрирует редкость гематогенного метастазирования (1). В литературе нами было обнаружено также 4 описания метастазов глиосаркомы в спинной мозг. В этих случаях более предпочтительной выглядит гипотеза ликворной диссеминации (5, 7, 8, 21, 30). Наличие спинальных метастазов следует подозревать при появлении у больного с глиосаркомой болей в спине, а также двигательных и чувствительных нарушений, характерных для компрессии спинного мозга. Ниже мы приводим
5
собственное клиническое наблюдение метастатического поражения корешков спинного мозга у пациента с глиосаркомой.
Пациент А. 28 лет поступил в клинику нервных болезней им. А.Я. Кожевникова им. И.М. Сеченова 17 сентября 2009 года. При поступлении предъявлял жалобы на ноющие боли в пояснице, с распространением на ноги, чувство онемения в стопах и «холода» в подошвах. Боли носили постоянный характер и имели тенденцию к усилению в ночное время суток. Болевой синдром купировался только инъекциями трамала. Из анамнеза было известно, что пациент оперирован в апреле 2008 года в городе Ростов-на-Дону по поводу злокачественной менингиомы левой височно-затылочной обл. (рис.1).
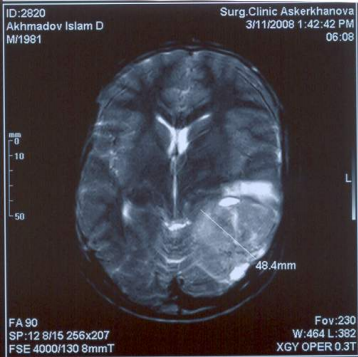 Рис. 1 . Предоперационное МРТ — исследование головного мозга. Сканирование в аксиальной плоскости в режиме Т1.
Рис. 1 . Предоперационное МРТ — исследование головного мозга. Сканирование в аксиальной плоскости в режиме Т1.
На томограмме в левой теменно-височно-затылочной области определяется патологическое объемное образование (опухоль) неправильной округлой формы около 5 см. в диаметре, расположенное конвекситально. Опухоль имеет негомогенный слегка гиперинтенсивный МР – сигнал. На поверхности образования определяются небольшие участки резко выраженного повышения МР-сигнала (кисты). Образование окружено зоной перифокального отека.
6
После операции получал лучевую и химиотерапию. В августе 2009 года пациент стал отмечать боли в пояснично-крестцовом отделе позвоночника с распространением по задне-наружным поверхностям бедер и голеней. Интенсивность болей быстро нарастала, отмечалось преобладание болей в ночное время. За 8 суток до госпитализации отметил чувство онемения и холода в стопах.
При поступлении в стационар состояние больного средней степени тяжести. Пациент пониженного питания, астенического сложения. Кожные покровы и видимые слизистые бледные. Тургор кожи снижен. По данным результатов клинико-лабораторных исследований выявляется железодефицитная анемия.
В неврологическом статусе: Сознание ясное. Пациент адекватен, контактен, полностью ориентирован. Выявляется спонтанный горизонтальный нистагм в крайних отведениях, сглаженность правой носогубной складки, девиация языка вправо. Правосторонний центральный гемипарез 4 балла, парез тыльного сгибания правой стопы 3 балла, мышечный тонус не изменен. Постуральный тремор в руках. Рефлексы живые, с легким преобладанием справа, патологических рефлексов нет. Описывает распространение боли
в зоне иннервации корешков L4-L5-S1 с обеих сторон. Из-за выраженности болевого синдрома самостоятельно не передвигается.
МРТ — исследование пояснично-крестцового отдела позвоночника с контрастным усилением выявило множественные мелкие опухоли корешков конского хвоста, расположенные на уровне L2 – L3 позвонков (рис.2).
Рис. 2. Контрольное КТ 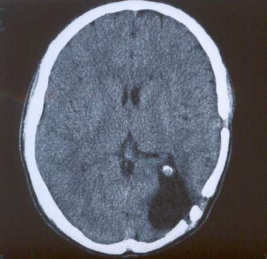
исследование головного мозга,
выполненное через 17 месяцев
после операции.
В зоне расположение опухоли
определяется послеоперационная
киста. Признаков рецидивного
опухолевого роста нет.
Множественный характер поражения корешков и злокачественная опухоль головного мозга в анамнезе позволяли предполагать возможную метастатическую природу
7
образований. Контрольное КТ исследование головного мозга выявило кистозную полость в зоне старой операции без четких признаков местного рецидива опухоли (рис.3). Таким образом, после нейровизуализации диагноз остался не ясен.
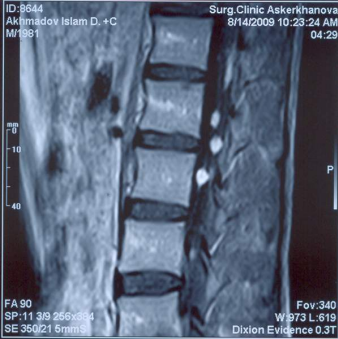
Рис. 3. МРТ — исследование поясничного отдела позвоночника, спинного мозга и корешков конского хвоста. Сканирование в коронарной плоскости в режиме Т1 с внутривенным контрастированием.
Определяются множественные небольшие четко отграниченные очаги интенсивного накопления контрастного вещества овальной и веретенообразной формы в проекции корешков конского хвоста (опухоли).
В связи с интенсивно нарастающим болевым синдромом вследствие сдавления корешков конского хвоста множественными опухолями 29.11.2009г. выполнена операция. В ходе вмешательства произведена ламинэктомия Л1 – Л3 позвонков. После вскрытия ТМО корешки конского хвоста выбухали в рану. Арахноидальная оболочка была замутнена. После ее рассечения при ревизии выявлено множественное опухолевое поражение корешков в виде участков веретенообразного вздутия протяженностью — 1.0 – 1,5см., диаметром — 0,5 – 0,8см. Опухолевые узлы имели коричнево — красный цвет и плотно-эластическую консистенцию. В зоне доступной осмотру на разных корешках обнаружено 3 подобные опухоли (рис.4). Помимо крупных образований в ткани корешков выявляется несколько мелких просовидных опухолей аналогичного вида. Крупные опухолевые узлы рыхло спаяны с окружающими корешками. Спайки тупо
8
разделены, крупные опухоли удалены. Корешки, на которых они располагались, пересечены выше и ниже образований. Удаление наиболее крупных образований позволило провести декомпрессию остальных корешков конского хвоста. В рану свободно начал поступать ликвор. С целью дополнительной декомпрессии корешков произведена пластика ТМО свободным фрагментом мышечной ткани.
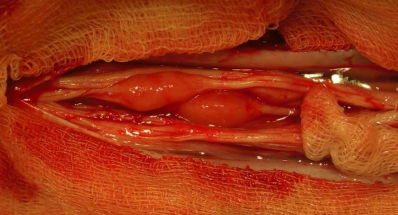 Рис.4. Интраоперационная фотография, выполненная после вскрытия ТМО, арахноидальной оболочки и разделения спаек. Видны множественные опухоли веретенообразной формы коричнево-красного цвета, обрастающие корешки конского хвоста.
Рис.4. Интраоперационная фотография, выполненная после вскрытия ТМО, арахноидальной оболочки и разделения спаек. Видны множественные опухоли веретенообразной формы коричнево-красного цвета, обрастающие корешки конского хвоста.
Послеоперационный период протекал без осложнений. Значительно уменьшился болевой синдром. Пациент начал самостоятельно ходить, свободно обслуживать себя. При микроскопическом исследовании препаратов из корешков конского хвоста выявлена опухолевая ткань, состоящая из полиморфных недифференцированных клеток, среди которых преобладали крупные круглые клетки с эозинофильной цитоплазмой и смещенным к периферии ядром, обращало на себя внимание обилие мелких сосудов; опухолевая ткань распространялась по поверхности и вглубь ткани корешка (рис.5). Для уточнения диагноза было проведено ИГХ исследование с АТ к GFAP, S-100, EMA, CD 34, EA, десмину и виментину, а также исследованы препараты удаленной в 2008г. опухоли головного мозга.
В препаратах головного мозга опухолевая ткань имела четкое бифракционное строение (рис.6), при ИГХ исследовании в глиальном компоненте опухоли было выявлено выраженное цитоплазматическое окрашивание с АТ к GFAP и S-100, тогда как в мезенхимальном компоненте было продемонстрировано выраженное цитоплазматическое окрашивание с АТ к виментину, многочисленные пролиферирующие сосуды
9
микроциркуляторного русла окрашивались с АТ к CD 34. Клетки опухоли не окрашивались с АТ к ЕМА и ЕА, что исключает менингиому и метастазы рака, окрашивание с АТ к десмину также было негативно. Как в глиальном, так и в мезенхимальном компоненте обнаружены признаки злокачественности: выраженный клеточный полиморфизм, большое количество митозов, в том числе патологических, пролиферация мелких сосудов, зоны некрозов. ИГХ исследование препаратов от первой (головной мозг) и второй (корешки конского хвоста) биопсий показало единый иммунофенотип опухоли с экспрессией GFAP, S-100 и виментина в опухолевых клетках, что подтверждает предположение о метастатической природе опухолей корешков. В опухолевой ткани из корешков конского хвоста определялось преимущественно окрашивание с АТ к GFAP, что свидетельствует о преобладании глиального компонента в метастазах.
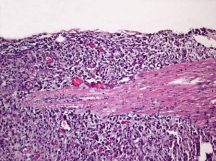
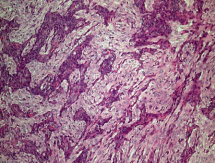
Рис.5. Микропрепарат удаленной опухоли корешка конского хвоста. Окраска – гематоксилин — эозин х 100.
Опухолевые клетки удлиненной формы, розового цвета. Хорошо видно врастание опухолевой ткани в ткань корешка.
Рис.6.Микропрепарат удаленной опухоли головного мозга. Окраска — гематоксилин – эозин х 100. Бифракционное строение опухоли.
На 16-е сутки после операции больной в удовлетворительном состоянии был выписан на амбулаторное лечении под наблюдение онколога. Пациент был предупрежден о нерадикальном характере операции и возможном проведении лучевой терапии.
Случай представляет интерес как иллюстрация сложности диагностики глиосаркомы и как первое клиническое описание множественных метастазов глиосаркомы в корешки конского хвоста.
В данном наблюдении имело место метастатическое поражение корешков конского хвоста преимущественно глиальным компонентом глиосаркомы. Микроскопическая картина демонстрировала низкодифференцированное злокачественное новообразование. Только использование иммуногистохимических тестов при исследовании метастазов с
10
последующим пересмотром и ИГХ исследованием материала первичной опухоли позволили определить бифракционное строение образования.
Наличие множественного метастатического поражения корешков конского хвоста является яркой иллюстрацией ликворной диссеминации процесса при глиосаркомах.
Список литературы .
1. Beamont T. L., Kupsky W. J., Barger G. R., Sloan А. E..
Gliosarcoma with multiple extracranial metastases: case report and review of the literature. J. Neurooncol. 2007. Vol. 83. P. 39 – 46.
2. Biernat W., Aguzzi A.,Sure U., Grant J.W., Kleihues P., Hegi M.E. Identical mutations of the p53 tumor suppressor gene in the gliomatous and the sarcomatous components of gliosacomas suggest a common origin from glial cells. J. Neuropathol. Exp. Neurol. 1995. Vol. 54. P. 651 – 656.
3. Boerman R.H., Anderl K., Herath J., Borell T., Johnson N., Schaeffer – Klein J., et. al. The glial and mesenchymal elements of gliosacomas share similar genetic alterations. J. Neuropathol. Exp. Neurol. 1996. Vol. 55. P. 973 – 981.
4. Cervoni L., Celli P. Cerebral gliosarcoma: prognostic factors. Neurosurg. Rev. 1996. Vol. 19. № 2. P. 93 – 96.
5. Demirci S., Akalin T., Islekel S., Ertan Y., Anacak Y. Multiple spinal metastases of cranial gliosarcoma: a case report and review of the literature. J. Neurooncol. 2008. Vol. 88. P. 199 – 204.
6. Feigin I., Gross S.W. Sarcoma arising in glioblastoma of the brain. Am. J. Pathol. 1955. Vol. 31. 633 – 655.
7. Firsching R., Schroder R., Koning W., Frowein R.A. Spinal drainage metastasis in cerebral glioblastoma/gliosarcoma. Nervenarzt. 1985. Vol. 56. P. 629 – 634.
8. Fischer S., Lee W., Aulisi E., Singh H. Gliosarcoma with
intramedullary spinal metastases: a case report and review of the literature.
11
J. clin. Oncology. 2007. Vol 25. № 4. P. 447 – 449.
9. Galanis E., Buckner J. C., Dinapoli R. P., Scheithauer B. W.,
Jenkins R. B., Wang C. H., O’ Fallon J. R., Farr G. Clinical outcome of gliosarcoma compared with glioblastoma multiforme: North central cancer treatment group results. J. Neurosurg. 1988. Vol. 89. № 3. P. 425 – 430.
10. Grant J.W., Steart P.Z., Agussi A., et al. Gliosarcoma: An immunohistochemical study. Acta Neuropathol. 1989. Vol. 79. P.305 – 309.
11. Hayashi K., Ohara N., Jeon H.J., et al. Gliosarcoma with features of chondroblastic Osteosarcoma. Cancer. 1991. Vol. 67. P. 2342 – 2349.
12. Ho K.L. Histogenesis of sarcomatous component of the gliosarcoma: an ultrastructural study. Acta neuropathol. 1990. Vol. 81. P. 178 – 188.
13. Khan E.M., Pandey R., Gupta S., Mittal P. Gliosarcomas: pathological spectrum. Indian j. cancer. 1994. Vol. 31. P. 118 – 123.
14. Lutterbach J., Guttenberger R., Pagenstecher A. Gliosarcoma: a clinical study. Radiotherapy and oncology. 2001. Vol. 61. P. 57 – 64.
15. Marucci G., Hadjmohammadi N., Cenni P., et al. Malignant glial tumor with skeletal tumor differentiation: Description of a case. Pathologica. 2000. Vol. 92. P. 198 – 203.
16. Maiuri F., Stella L., Benvenuti D., Giamundo A., Pettinato G..
Cerebral gliosarcomas: correlation of computed tomographic findings, surgical aspect, pathological features, and prognosis. Neurosurg. 1990. Vol 26. № 2. P. 261 – 267.
17. Meis J. M., M.D., Marts K. L., M.S. and Nelson J. S., M.D. Mixed glioblastoma multiforme and sarcoma. Cancer. 1991. Vol.67. № 1. P. 2342 – 2349.
18. Morants R.A., Feigin I., Ransohoff J. Clinical and pathological study of 24 cases of
12
gliosarcoma. J. Neurosurg. 1976. Vol. 45. P. 398 – 408.
19. Ng H.G., Poon W.S. Gliosarcoma of the posterior fossa with features of a malignant fibrous histiocytoma. Cancer. 1990. Vol. 65. P. 1161 – 1166.
20. Ozolek J.A., Finkelstein S.D., Couce M.E. Gliosarcoma with epithelial differentiation: Immunohistochemical and molecular characterization. Case report and review of the literature. Mod. Pathol. 2004. Vol.17. P. 739 – 745.
21. Pacos E.E., Goussia A.C., Zina V.P., et. al. Multi-focal gliosarcoma: a case report and review of the literature. J. Neurooncol. 2005. Vol.74. P. 301 – 304.
22. Parech H.C., O’ Donovan D.G., Sharma R.R., Keogh A.J. Primary cerebral gliosarcoma: Report of 17 cases. Br. J. Neurosurg. 1995. Vol. 9. P. 171 – 178.
23. Perry J.R., Ang L.C., Bilbao J.M., Muller P.J. Clinicopathologic features of primary and postirradiation cerebral gliosarcoma. Cancer. 1995. Vol. 75. 2910 – 2918.
24. Reis R. M., Könü-Lebleblicioglu D., Lopes J. M., Kleihues P.and Ohgaki H. Genetic profile of gliosarcomas. Am. J. pathology. 2000. Vol. 156. P. 425-432.
25. Sade B., Prayson R. A., and Lee J. H. Gliosarcoma with ifratemporal fossa extension. Case report. J. Neurosurg. 2006. Vol. 105. № 6.
26. Salvati M., Caroli E., Raco A., Giangaspero F., Delfini R., Ferrante L. Gliosarcoma: analysis of 11 cases do two subtypes exist? J. neurooncol. 2005. Vol 74. № 1. P. 59 – 63.
27. Sarkar C., Sharma M.C., Sudha K., Gaikwad S., Varma A. A clinicopathological study of 29 cases of gliosarcoma with special reference to two unique variants. Indian j. med. Res. 1997. Vol. 106. P. 229 -235.
28. Sreenan J.J., Prayson R.A.: Gliosarcoma. A study of 13 tumors, including p53 and CD 24 immunohistochemistry. Arch. Pathol. Lab. Med. 1997. Feb. Vol. 121. № 2. P. 129 – 133.
13
29. Smith D.R., Hardman I.M., Earle K.M. Contigious glioblastoma multiforme and fibrosarcoma with extracranial metastasis. Cancer. 1969. Vol. 24. 270 – 276.
30. Witwer B.P., Salamat M.S., Resnick D.K. Gliosarcoma metastatic to the cervical spinal cord: Case report and review of the literature. Surg. Neurol. 2000. Vol. 54. P. 373 – 378.

Для отправки комментария необходимо войти на сайт.