Евзиков Г.Ю.*, Егоров О.Е.*, Кушель Ю.В.**
Хирургическое лечение идиопатической грыжи спинного мозга (наблюдение из практики и обзор литературы).
Клиника нервных болезней I МГМУ им. И.М. Сеченова*
НИИ нейрохирургии им. Н.Н. Бурденко **
Резюме
В статье приведено клиническое наблюдение идиопатической спинномозговой грыжи. Это редкое патологическое состояние определяется как деформация спинного мозга, выступающего в вентральном направлении за пределы твердой мозговой оболочки. Причиной образования грыжи является вентральный дефект твердой мозговой оболочки (грыжевые ворота), происхождение которого в настоящее время дискутабельно. Спинной мозг пролабирует в дефект и плотно фиксируется в нем. Заболевание характеризуется симптомами медленно прогрессирующей миелопатии и проявляется нарастающими пирамидными и чувствительными расстройствами в ногах. Хирургическое лечение имеет приоритетное значение в лечении идиопатических спинномозговых грыж и приводит к успеху в 73-75% наблюдений.
Введение
Идиопатические грыжи спинного мозга (ИГСМ) были впервые описаны G.Wortsman в 1974 году и определяются как состояние, при котором спинной мозг выступает в вентральном направлении через дефект дурального мешка за пределы твердой мозговой оболочки обычно на средне-грудном уровне. После описания первого случая с середины 90-х годов стали появляться отдельные публикации об этом патологическом состоянии
(1,2,3,4,10,19,20,21,23,25,29,32,34,36,44,46,48,49,53). Всего со времени описания этой патологии G.Wortsman в мировой литературе упоминается о 118 случаев ИГСМ. Патология наблюдаются у пациентов средней возрастной категории, немного чаще у женщин, и характеризуются прогрессирующим сенсорно-моторным дефицитом в нижних конечностях. Частота встречаемости ИГСМ среди оперированных спинальных
больных составляет не более 0,08 % (15). Истинная частота встречаемости в популяции неизвестна из-за малого количества наблюдений. Среди возможных причин формирования ИГСМ разные авторы отмечают врожденные аномалии развития, легкие травмы и арахноидальные кисты, но определенной теории образования ИГСМ пока нет(5, 16, 22, 25, 43, 45).
В данной статье представлено клиническое наблюдение пациентки с ИГСМ и обзор литературы, посвященной этой патологии. Подобных описаний в отечественной литературе нам на настоящий момент обнаружить не удалось
Описание клинического случая.
Больная Р., 48 лет поступила в нейрохирургическое отделение клиники нервных болезней 1-го МГМУ им. И. М. Сеченова с жалобами на онемение в нижней половине туловища и в ногах, слабость и неловкость в ногах, пошатывание при ходьбе в темноте. Из анамнеза известно, что 10 лет назад отметила расстройства температурной чувствительности в левой стопе. Через несколько месяцев аналогичные чувствительные расстройства возникли и в правой стопе. Постепенно, в течение нескольких лет онемение в ногах поднялось до уровня нижней трети голеней. Летом 2009 года возникло ощущение напряжения и появились непроизвольные сокращения мышц в ногах «ноги самостоятельно отдергивались при надевании туфель». Больная стала отмечать подъем верхней границы чувствительных расстройств до паховой области. В январе 2010 года на фоне физической нагрузки возникла слабость в ногах, больше слева. Больная отметила, что подволакивает левую ногу при ходьбе. За 2 месяца до госпитализации присоединилось учащение мочеиспускания.
В неврологическом статусе при поступлении отмечается нижний спастический парапарез со снижением мышечной силы до 4-х баллов слева и 4,5 баллов справа, с клонусами стоп и двухсторонними патологическими стопными знаками. Наблюдаются расстройства поверхностной чувствительности по проводниковому типу с уровня
сегмента Т 6. Отмечено пошатывание при ходьбе с закрытыми глазами и в позе Ромберга при закрывании глаз.
Данные лабораторных анализов:
Общий анализ крови: Лс 9,6 х103 , Эр 4,15 х 103 , Нв 12,6 г/л, Пал 3%, Сегм 67, эоз 2, лимф 18, мон 10, СОЭ 7 мм ч; общий анализ мочи: р-я кисл, уд вес 1037, белок – следы, сахар, ацетон, желчные пигменты – нет, Эр – нет, Лс 0-1 в п.з. Биохимич. анализ крови: без патологических отклонении. Коагулограмма: в пределах нормы.
ЭКГ: синусовый ритм, ЧСС 72 в мин, нормальное положение ЭОС.
ССВП: поражение быстропроводящих волокон с левой ноги выше уровня поясничного утолщения, недостаточность афферентации по волокнам болевой и температурной чувствительности с правой ноги легкой степени.
МРТ грудного отдела спинного мозга: обнаружено вентральное смещение и V-образная деформация спинного мозга на уровне тела Т 5 позвонка, расширение заднего субарахноидального пространства, отсутствие переднего субарахноидального пространства на указанном уровне (рис.1).
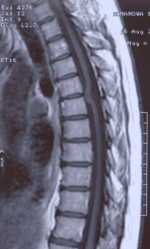
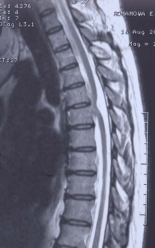
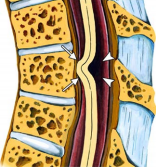
Рис.1А,Б,В. МРТ-исследование грудного отдела позвоночника и спинного мозга в сагиттальной плоскости в режимах Т1(А) и Т2 (Б). На уровне 5-6 грудных позвонков отмечается выраженная деформация спинного мозга и локальная фиксация мозга к вентральной стенке позвоночного канала. Переднее субарахноидальное пространство на этом участке отсутствует. Типичная МР — картина ИГСМ. Рис 1В. Аналогичная картина в виде схемы ИГСМ в сагиттальной плоскости, приведенная в статье Parmar H. et al. Radiographics 2008; 28; 511-518.
КТ – миелография : вентральное смещение спинного мозга с деформацией мозга на уровне тела Т 5 позвонка, расширение заднего субарахноидального пространства без локального блока проведения контрастного вещества, отсутствие переднего субарахноидального пространства (рис.2).
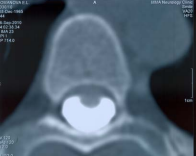
 Рис.2 А,Б. КТ – миелография. Исследование грудного отдела позвоночника и спинного мозга в сагиттальной (А) и аксиальной (Б) плоскости. Отмечается вентральное смещение и локальное истончение спинного мозга. Заднее ликвороносное пространство полностью проходимо. Признаков локальной арахноидальной кисты на уровне участка патологической деформации мозга нет.
Рис.2 А,Б. КТ – миелография. Исследование грудного отдела позвоночника и спинного мозга в сагиттальной (А) и аксиальной (Б) плоскости. Отмечается вентральное смещение и локальное истончение спинного мозга. Заднее ликвороносное пространство полностью проходимо. Признаков локальной арахноидальной кисты на уровне участка патологической деформации мозга нет.
Больной был установлен клинический диагноз: идиопатическая спинномозговая грыжа на уровне Тн5.
Произведена операция — менингомиелолиз на уровне T5 — T 6 позвонков. Вмешательство выполнено на правом боку под э/т наркозом. Произведена ламинэктомия T 5 – T 6 позвонков с медиальной фасетэктомией справа. В ходе ламинэктомии обращал на себя внимание спаечный процесс в эпидуральном пространстве и уплотнение эпидуральной клетчатки, которая напоминала достаточно плотный соединительнотканный футляр. Дуральный мешок был умеренно напряжен, не пульсировал. После рассечения эпидуральной клетчатки и ТМО было видно, что арахноидальная оболочка спаяна с внутренней поверхностью ТМО, уплотнена. После рассечения арахноидальной облочки и разделения отдельных спаек в заднем ликвороносном пространстве был обнажен спинной мозг. При осмотре мозг истончен, смещен вентрально и влево, где спаян с вентральной поверхностью дурального мешка (рис.3а). Произведено рассечение двух зубовидных связок слева выше и ниже места фиксации спинного мозга. При ротации мозга за остатки зубовидных связок было видно, что вентральная поверхность дурального мешка смещается со спинным мозгом и баллотирует. Чуть выше области фиксации спинного мозга на вентральной поверхности дурального мешка имелся небольшой щелевидный дефект ТМО, примыкающий сверху к месту фиксации. Видно, что в передней части эпидурального пространства циркулирует ликвор (рис.3б). Перидуральной клетчатки на вентральной поверхности позвоночного канала в месте дефекта нет. С помощью микродиссекторов спайки между мозгом и вентральной повехностью дурального мешка были рассечены. Обнаружена мозговая грыжа,
находившаяся в переднем эпидуральном пространстве. ТМО дополнительно рассечена на 1,0 см. вверх и вниз от места грыжевых ворот. Общая протяженность рассечения ТМО (включая область грыжевых ворот) составляет около 3,0 – 3,5 см. (рис.3в). Волокна двигательной порции левого корешка T 5, плотно фиксированые к ТМО в области грыжевых ворот, были пресечены. После менингомиелолиза спинной мозг начал смещаться свободно, независимо от ТМО. При осмотре задней поверхности позвонков через участок рассечения ТМО были видны участки узурации кости (рис.3г). После гемостаза ТМО задней поверхности дурального мешка была ушита наглухо. Рана послойно ушита.
Рана зажила первичным натяжением В течение 2-х недель после операции отмечено постепенное улучшение неврологических функций, полный регресс парапареза и проводниковых чувствительных расстройств, нормализация мочеиспускания.
(операция на правом боку). 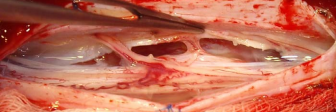
Открыт участок дефекта
ТМО на вентральной
поверхности в области
грыжи, который
предварительно
распрепарирован
диссекторами. Через дефект
видны структуры
вентрального эпидурального 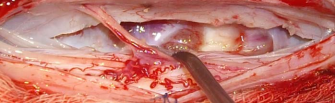
пространства, лишенные
клетчатки.
В). Вид операционной раны
после миелолиза и широкого
рассечения грыжевых ворот.
Мозг свободно мобилизуется.
Видны задняя и передняя
порции корешка T5. Передняя
порция корешка (находится 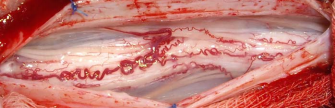
под пинцетом) спаяна с
ТМО.
Г). Вид операционной раны
после пересечения
двигательной порции корешка.
Спинной мозг свободно
смещается диссектором.
Через отверстие в
Рис.3А.Б.В.Г. Интраоперационная фотография.
А) Вид спинного мозга после вскрытия арахноидальной облочки и иссечения спаек. Видна деформация спинного мозга и место его фиксации к вентральной поверхности ТМО чуть слева от средней линии.
Б). Вид раны после рассечения зубовидных связок и частичного смещения спинного мозга вправо под действием собственного веса
вентральной поверхности ТМО видно узурирование задней поверхности тела позвонка. Участок узурации имеет серовато-коричневый цвет.
Обсуждение.
В настоящее время считается, что ведущим звеном в патогенезе ИГСМ является врожденное или приобретенное истончение твердой мозговой оболочки с постепенным расслоением и образованием в ней продольных дефектов(1, 9, 42). В качестве возможных причин истончения ТМО и образования ИГСМ обсуждались грыжи диска на грудном уровне (28, 31, 36). Было отмечено, что на уровне межпозвоночных дисков ИГСМ встречается в 67% наблюдений, но при этом не было обнаружено сопутствующих грыж, компремирующих дуральный мешок (15%). Некоторые авторы предполагали, что пролежень твердой мозговой оболочки может формироваться из-за переднего смещения спинного мозга вследствие торакального гиперкифоза (22). Однако при измерениях оказалось, что все пациенты имеют нормальные показатели грудного кифоза — в среднем 33 град., и ни у кого из пациентов не было локального ангулярного кифоза. Таким образом, патогенез ИГСМ до настоящего момента остается неизвестным (5). Причины патологической фиксации спинного мозга в дефекте ТМО также не ясны. Гистологическое исследование иссеченных фрагментов ТМО из области грыжевых ворот не выявили признаков хронического воспаления оболочек (15).
Усовершенствование методов диагностики с применением МРТ увеличило число диагностированных случаев ИГСМ в последние годы, что позволило ознакомить нейрохирургов с данной патологией. Однако ограниченное число пациентов создает трудности для описания клинической картины, определения частоты встречаемости, создания классификации этого заболевания(4, 6, 11, 35, 52).
ИГСМ не имеет характерной клинической картины. Заболевание обычно проявляется разнообразными спинальными симптомами, составляющими неврологическую картину медленно прогрессирующей миелопатии с поражением грудного отдела спинного мозга (53). Невозможно четко определить, что является причиной развития симптоматики: патологическая фиксация или компрессия мозга в грыжевых воротах? Боли в спине и парестезии являются главной жалобой больного
в дебюте заболевания в 10% случаев, а к моменту проведения операции отмечаются приблизительно у половины больных (7, 11, 13, 19, 41, 45, 47, 50, 51). Многие авторы отмечают частое развитие синдрома Броун-Секара, который встречается с частотой от 40 до 80 % наблюдений (15, 18, 24, 35, 38, 48, 49). На момент проведения оперативного вмешательства моторные расстройства в виде пирамидного монопареза в нижних конечностях имеют место у 90% больных, парапареза – у 10% больных (49).
Расстройства болевой и температурной чувствительности наблюдаются у 90% больных. Дисфункция мочевого пузыря имеет место в 17% наблюдений (15,27). Средний срок развития заболевания от дебюта клинических проявлений до хирургического вмешательства составляет в среднем около 6 лет (колебания в пределах от 12 до 180 месяцев).
МРТ — исследование является основой диагностики ИГСМ. Японские авторы, используя кооперативный материал нескольких клиник, в 2009г. провели анализ группы больных из 12 человек и впервые предложили нейровизуализационную классификация ИГСМ (15,16,17). Это первое исследование, в котором тяжесть симптомов и исходы операций у больных с ИГСМ были оценены на основании данных МРТ-исследования. В зависимости от картины МР — изменений по данным исследования в сагиттальной проекции все случаи подразделены на 3 типа: К-тип (kink type) – V – образное искривление спинного мозга в вентральном направлении (представлено в описанном нами случае), D-тип (discontinious type) — при котором спинной мозг полностью исчезает из дурального мешка на уровне грыжевого выпячивания (возникает, как правило, при полном выходе участка мозга в вентральное эпидуральное пространство в условиях латерального расположения грыжевых ворот и боковом смещении всего спинного мозга, что дает видимость его прерывания на сагиттальных изображениях.), Р – тип (protrusion type) – при котором отсутствует видимое искривление спинного мозга, но исчезает переднее субарахноидального пространство за счет спаивания мозга с оболочками в области грыжевых ворот. Узурация задней поверхности тела позвонка, соответствующая расположению грыжи, была отмечена в 42% случаев. На основании анализа сагиттальных срезов грыжевые ворота (дефект в твердой мозговой оболочке) подразделяют на центральный — С тип и латеральный — L тип. 50 % пациентов имеют центральную локализацию грыжевых ворот, 50% — латеральную (или правильнее сказать — вентро-латеральную). Тип грыжи по данным МР — исследования в сагиттальной плоскости (К,D,P) не оказывал существенного влияния на длительность и тяжесть клинических проявлений. По данным сканирования в аксиальной плоскости, пациенты с центральным расположением дефекта (тип С) имеют более тяжелый предоперационный неврологический дефект, нежели пациенты с латеральной локализацией (тип L). Костный дефект в теле позвонка также отмечается у пациентов с существенным предоперационным неврологическим дефицитом (14,15).
При невозможности выполнить МР-исследование у больного с подозрением на ИГСМ может быть произведена КТ-миелография. Необходимо отметить, что данные
КТ-миелографии в приведенном нами наблюдении значительно менее информативны в плане диагностики ИГСМ. В частности, в нашем наблюдении К-тип ( kink type) деформации мозга на сагиттальных срезах при МР-исследовании выявляется намного отчетливей, чем при КТ-миелографии.
Дифференциальный диагноз ИГСМ следует проводить со спинальной арахноидальной кистой. Существенным дифференциально-диагностическим критерием может служить отсутствие миелографического блока при ИГСМ, что позволяет исключить дорзальную компрессию мозга кистой (24). Фазово-контрастная МРТ может быть полезна для исключения арахноидальной кисты и может заменить миелографию и КТ-миелографию (8, 37). Предложено несколько способов хирургического лечения ИГСМ. Единого стандарта для этих операций в настоящее время нет. Цель операции состоит в освобождении спинного мозга из грыжевых ворот, возвращении спинного мозга в нормальное положение и предотвращении повторного образования ИГСМ. Вне зависимости от техники вмешательства, операции при ИГСМ необходимо проводить из достаточно широкого доступа с пересечением зубовидных связок для свободного обзора вентральной поверхности дурального мешка и зоны грыжевых ворот. Критериями адекватного освобождения мозга из грыжевых ворот являются: возвращение в нормальное положение в позвоночном канале, восстановление подвижности и активной пульсации спинного мозга (4,18,20). Вопрос о дальнейших действиях по отношению к дефекту ТМО дискутабелен. Wortsman, впервые описавший ИГСМ (1974г), предложил проводить операцию, включающую менингомиелолиз с последующим ушиванием грыжевых ворот ТМО (54). Существенным недостатком методики является неудобство ушивания ТМО вентральной поверхности дурального мешка, что сопряжено с высоким риском тракционной травмы спинного мозга. Еще одной проблемой является риск стенозирования дурального мешка при его ушивании в условиях дефекта оболочечной ткани (44). Masuzawa (1981г.) предложил метод пластики дефекта вентральной ТМО с помощью трансплантатов (25). Для трансплантации могут быть использованы мышцы, лиофилизированная твердая мозговая оболочка, аллоткани (4,10,12). Метод патогенетически обоснован, т.к. исключает интраоперационное стенозирование дурального мешка и предотвращает образование рецидивной спинномозговой грыжи. Его отрицательной стороной является возможность развития спаечного процесса на вентральной поверхности дурального мешка с последующей вторичной фиксацией спинного мозга при использовании аутотрансплантантов для пластики ТМО и отсутствие надежной герметизации дурального мешка при
использовании аллотрансплантантов. Метод расширения грыжевых ворот H. Nakazawa (1993г.) был предложен с целью максимального снижения риска тракционной или ротационной травмы спинного мозга в ходе вмешательства и удобен для центральных грыж. В ходе операции проводится менингомиелолиз с последующим широким рассечением грыжевых ворот для предупреждения повторного ущемления спинного мозга. Дополнительной пластики ТМО в ходе вмешательства не проводится. Отказ от пластики грыжевых ворот, по мнению автора, не сопряжен с высокой степенью риска повторного образования грыжи (33). Операция несет минимальный риск повреждения спинного мозга, но создает условия для скопления ликвора в вентральном эпидуральном пространстве и не исключает развитие вторичной фиксации спинного мозга в зоне операции в случае развития спаечного процесса (20).
Выбор оптимальной методики операции в настоящее время затруднен в связи с невозможностью при столь редкой патологии сформировать адекватные группы сравнения. В целом на основе имеющегося литературного материала можно заключить, что в послеоперационном периоде улучшение имеет место у 73 — 75% пациентов, неврологический статус на дооперационном уровне остается у 20% пациентов, ухудшение наблюдают у 5 – 7% (15,18). К прогностическим факторам хорошего послеоперационного исхода относят наличие неглубокого неврологического дефицита в дооперационном периоде, нейровизуализационный тип грыжи — Р, отсутствие деструкции костной ткани в месте локализации ИГСМ (15, 35, 51). К прогностическим факторам плохого послеоперационного исхода относят спастический пара- и монопарез в дебюте заболевания (только 47% хороших исходов), наличие глубокого неврологического дефицита в дооперационном периоде, нейровизуализационный тип грыжи — С, наличие деструкции костной ткани в месте локализации ИГСМ, гиперинтенсивный сигнал в Т2-режиме от паренхимы спинного мозга (3, 15,51).
В представленном нами клиническом случае у пациентки имела место грыжа, соответствующая классификационному типу – KL. Была произведена операция по методике Nakazawa, после которой отмечен полный регресс неврологических расстройств. Наблюдение представляет интерес в связи с отсутствием подробных описаний данной патологии в отечественной литературе.
Список литературы к статье «Хирургическое лечение идиопатической грыжи спинного мозга (наблюдение из практики и обзор литературы)». Евзиков Г.Ю. и соавт.
1) Aizawa T., Sato T., Tanaka Y., Kotajima S., Sekiya M, Kokobun S. Idiopathic herniation of the thoracic spinal cord: report of three cases// Spine. — 2001. — № 26. – P. 488- 491. 2) Aquilina K, Nanra JS, Rawluk D. Idiopathic spinal cord hernia// Ir Med J. – 2004. — № 97. – Р.115–116.
3) Barbagallo GM, Marshman LA, Hardwidge C, Gullan RW. Thorasicididopathic spinal cord herniation at the vertebral body level: a subgroup with a poor prognosis? Case reports and review of the literature // J Neurosurg. – 2002. — № 97. – Р. 369–376.
4) Barrenechea IJ, Lesser JB, Gidekel AL, Turjanski L, Perin NI. Diagnosis and treatment of spinal cord herniation: a combined experience// J Neurosurg Spine. — 2006. – № 4. – Р. 294– 302.
5) Bartolomei J, Wong J, Awad IA, et al. Case problems conference: thoracic spinal cord hernia// Neurosurgery. — 2000. — № 46. – Р. 1408–1415.
6) Baur A, Stäbler A, Psenner K, Hamburger C, Reiser M. Imaging findings in patients with ventral dural defects and herniation of neural tissue// Eur Radiol. – 1997. — № 8. – Р. 1259– 1263.
7) Borges LF, Zervas NT, Lehrich JR. Idiopathic spinal cord herniation: a treatable cause of the Brown-Sequard syndrome. Case report// Neurosurgery. – 1995 — № 26. – Р. 1028–1032. 8) Brugieres P, Malapert D, Adle-Biassette H, Fuerxer F, Djindjian M. Gaston A. Idiopathic spinal cord herniation: value of MR phase-contrast imaging// AJNR Am J Neuroradiol. — 1999. — № 20. – Р. 935–939.
9) Dix JE, Griffitt W, Yates C, Johson B. Spontaneous thoracic spinal cord herniation through an anterior dural defect// AJNR AMJ Neuroradiol. – 1998 — №19. – Р. 1345–1348. 10) Ewald C, Kohne D, Hassler WE. Progressive spontaneous herniation of the thoracic spinal cord: case report// Neurosurgery. – 2000. — № 46. – Р. 493–495.
11) Ferre JC, Carsin-Nicol B, Hamlat A, Carsin M, Morandi X. MR imaging features of idiopathic thoracic spinal cord herniations using combined 3D-fiesta and 2D-PC Cine techniques// J Neuroradiol. – 2005. — № 32. – Р. 125–130.
12) Gellerini M, Bayon S, Scazzeri F, et al. Idiopathic spinal cord herniation: a treatable cause of Brown-Sequard syndrome// Acta Neurochir (Wien). — 2002. — № 144. – Р. 321–325. 13) Hausmann ON, Moseleg IF. Idiopathic dural herniation of the thoracic spinal cord. Neuroradiology. – 1996. — № 38. – Р. 503–510.
14) Henry A, Tunkel R, Arbit E, Ku A, Lachmann E. Tethered thoracic cord resulting from spinal cord herniation // Arch Phys Med Rehabil. – 1997. — № 78. – Р. 530–533. 15) Imagama S., Matsuyama Y., Sakai Y., Nakamura H., Katayma Y., Ito Z., Wakao N., Sato K., Kamiya M., Kato F., Yukawa Y., Miura Y., Yoshihara H., Suzuki K., Ando K., Hirano K., Tauchi R., Muramoto A., Ishiguro N. Image classification of idiopathic spinal cord herniation based on symptom severity and surgical outcome: a multicenter study // J. neurosurg. — Spine. – 2009. — № 11. – Р. 310 -319.
16) Isu T, Iizuka T, Iwasaki Y, Nagashima M, Akino M, Abe H. Spinal cord herniation associated with an intradural spinal arachnoid cyst diagnosed by magnetic resonance imaging // Neurosurgery. – 1991. — № 29. – Р.137–139.
17) Karadeniz-Bilgili MY, Castillo M, Bernard E. Transdural spinal cord herniation: pre- and postoperative MRI findings // Clin Imaging. – 2005. — № 29. – Р.288–290. 18) Kawachi I, Nozaki H, Watanabe M, Sato A, Tsuji S. Spontaneous spinal cord herniation // Neurology. — 2001. — № 56 – Р. 977.
19) Kumar R, Taha J, Greiner AL. Herniation of the spinal cord: case report // J Neurosurg. – 1995. — № 82. – Р. 131–136.
20) Maira G, Denaro L, Doglietto F, Mangiola A, Colosimo C. Idiopathic spinal cord herniation: diagnostic, surgical, and follow-up data obtained in five cases // J Neurosurg Spine. — 2006. — № 4. – Р. 10–19.
21) Marshman LA, Hardwidge C, Ford-Dunn SC, Olney JS. Idiopathic spinal cord herniation: case report and review of the literature // Neurosurgery. – 1999. — № 44. – Р. 1129–1133. 22) Martin G. Spinal cord herniation into an extradural arachnoid cyst // J Clin Neurosci. — 2000. — № 7. – Р. 330–331.
23) Maruichi K, Hida K, Seki T, Iwasaki Y. Idiopathic spinal cord herniation which extended remarkably up- and downward from dural defect: case report // No Shinkei Geka. – 2004. — № 32. – Р. 509–512.
24) Massicotte EM, Montanera W, Ross Fleming JF, et al. Idiopathic spinal cord herniation: report of eight cases and review of the literature // Spine. — 2002. — № 27. — № 9. – Р. 233– 241.
25) Masuzawa H, Nakayama H, Shitara N, Suzuki T. Spinal cord herniation into a congenital extradural arachnoid cyst causing Brown-Sequard syndrome: case report // J Neurosurg. — 1981. — № 55. – Р. 983–986.
26) Matsumura T, Takahashi MP, Nozaki S, Kang J. A case of idiopathic spinal cord herniation // Rinsho Shinkeigaku. – 1996. — № 36. – Р. 566–570.
27) Miura Y, Mimatsu K, Matsuyama Y, Yoneda M, Iwata H. Idiopathic spinal cord herniation // Neuroradiology. – 1996. — № 38. – Р. 155–156.
28) Miyaguchi M, Nakamura H, Shakudo M, Inoue Y, Yamano Y. Idiopathic spinal cord herniation associated with intervertebral disc extrusion // Spine. – 2001. — № 26 (9). – Р. 1090–1094.
29) Miyake S, Tamaki N, Nagashima T, Kurata H, Eguchi T, Kimura H. Idiopathic spinal cord herniation report of two cases and review of the literature// J Neurosurg. – 1998. — № 88. – Р. 331–335.
30) Morokoff AP, Tress BM, Kaye AH. Idiopathic spinal cord herniation // J Clin Neurosci. – 2001. — № 8 – Р. 180–183.
31)Najgar MW, Baeesa SS, Lingawi SS. Idiopathic spinal cord herniation: a new theory of pathogenesis. Surg Neurol. // 2004. — № 62. – Р. 161–170.
32)Nakagawa H, Kamimura M, Uchiyama S, Takahara K, Itsubo T, Miyasaka T. Idiopathic spinal cord herniation associated with a large erosive bone defect: a case report and review of the literature // J Spinal Disord Tech. – 2003. — № 16. – Р. 299–305.
33)Nakazawa H, Toyama Y, Satomi K, Fujimura Y, Hirabayashi K. Idiopathic spinal cord herniation: report of two cases and review of the literature // Spine. – 1993. — № 18. — Р. 2138–2141.
34) Oe T, Hoshino Y, Kuarkowa T. A case of idiopathic herniation of spinal cord associated with duplicated dura mater and with an arachnoid cyst // Nippon Seikeigeka Gakkai Zasshi. —1990. — № 64. – Р. 43–49.
35) Pereira P, Duarte F, Lamas R, Vaz R. Idiopathic spinal cord herniation: case report and literature review // Acta Neurochir (Wien). – 2001. — № 143. – Р. 401–406. 36) Sagiuchi T, Iida H, Tachibana S, Utsuki S, Tanaka R, Fujii K. Idiopathic spinal cord herniation associated with calcified thoracic disc extrusion: case report // Neurol Med Chir. — (Tokyo). — 2003. — № 43. – Р. 364–368.
37) Saito A, Takahashi T, Sato S, Kumabe T, Tominaga T. Modified surgical technique for the treatment of idiopathic spinal cord herniation // Minim Invasive Neurosurg. – 2006. — № 49. – Р. 120–123.
38) Saito T, Anamizu Y, Nakamura K, Seichi A. Case of idiopathic thoracic spinal cord herniation with a chronic history: a case report and review of the literature // J Orthop Sci. — 2004. — № 9. – Р. 94–98.
39) Sasaoka R, Nakamura H, Yamanyo Y. Idiopathic spinal cord herniation in the thoracic spine as a cause of intractable leg pain: case report and review of the literature // J Spinal Cord Tech. – 2003. — № 16. – Р. 288–294.
40) Sioutos P, Arbit E, Tsairis P, Gargan R. Spontaneous thoracic spinal cord herniation: a case report // Spine. – 1996. — № 21. – Р. 1710–1713.
41) Slavotinek JP, Sage MR, Brophy BP. An usual spinal intradural arachnoid cyst // Neuroradiology. – 1996. — № 38. – Р. 152–154.
42) Sugimoto T, Kasai Y, Takegami K, Morimoto R, Maeda M, Uchida A. A case of idiopathic spinal cord herniation with duplicated dura mater // J Spinal Disord Tech. – 2005. — № 18. – Р. 106–111.
43) Tekkok I.H. Spinal cord herniation – which one is really traumatic ? // AJNR AM. J. Neuroradiol. — 2000. — № 21. – Р. 609 – 612
44) Tekkok IH. Spontaneous spinal cord herniation: case report and review of the literature // Neurosurgery. – 2000. — № 46. – Р. 485–491.
45) Tronnier VM, Steinmetz A, Albert FK, Scharf J, Kunze S. Hernia of the spinal cord: case report and review of the literature // Neurosurgery. – 1991. — № 29. – Р. 916–919. 46) Uchino A, Kato A, Mamozaki N, Yukitake M, Kudo S. Spinal cord herniation: report of two cases and review of the literature // Eur Radiol. – 1997. — № 7. – Р. 289–292. 47) Vallee B, Mercier P, Menei P, et al. Ventral transdural herniation of the thoracic spinal cord. Surgical treatment in four cases and review of literature // Acta Neurochir Wien. – 1999. -№ 141. – Р. 907–913.
48) Verny C, Mercier P, Hayek G, Fournier D, Menei P, Guy G. Spontaneous spinal cord herniation: a little-known cause of Brown-Sequard syndrome. Report of two cases and review of the literature // Neurochirurgie. – 1999. — № 45. – Р. 225–231.
49) Wada E, Yonebu K, Kang J. Idiopathic spinal cord herniation: report of three cases and review of the literature // Spine. – 2000. — № 25. – Р. — 1984–1988.
50) Watanabe M, Chiba K, Matsumato M, Maruiwa H, Fujimura Y, Toyama Y. Surgical management of idiopathic spinal cord herniation: a review of nine cases treated by the enlargement of the dural defect // J Neurosurg. – 2002. — № 96. – Р. 359–360.
51) Watters MR, Stears JC, Osborn AG, et al. Transdural spinal cord herniation: imaging and clinical spectra // AJNR AM J Neuroradiol. – 1998. — № 19. – Р.1337–1344. 52) White B, Firth JL. Anterior spinal hernia: an increasingly recognized cause of thoracic cord dysfunction // J Neurol Neurosurg Psychiatry. – 1994. — № 54. – Р. 1433–1435. 53) White BD, Tsegage M. Idiopathic anterior spinal cord hernia: under-recognized cause of thoracic myelopathy // Br J Neurosurg. – 2004. — № 18. – Р. 246–249.
54) Wortzman G, Tasker RR, Rewcastle NB, Richardson JC, Pearson FG. Spontaneous incarcerated herniation of the spinal cord into a vertebral body: a unique cause of paraplegia. Case report // J Neurosurg. – 1974. — № 41 – Р. 631–635.

Для отправки комментария необходимо войти на сайт.