1
Евзиков Г.Ю*, Бублиевский Д.В.*, Шашкова Е.В.**, Абдалова О.В.**, Баранова О.В.***
Хирургическое и последующее радиохирургическое лечение множественных гемангиобластом спинного мозга и продолговатого мозга у пациента с болезнью Гиппеля — Линдау.
Клиническое наблюдение и обзор литературы.
Клиника нервных болезней им. А.Я. Кожевникова*, кафедра лучевой диагностики**, кафедра патологической анатомии*** Московской медицинской академии им. И.М. Сеченова.
Болезнь Гиппеля-Линдау (Г-Л) (синонимы: ретинальный ангиоматоз, ретиноцеребровисцеральный ангиоматоз, ангиобластоматоз, ангиофакоматоз сетчатки и мозжечка, множественный ангиоретикуломатоз, гемангиобластоматоз) представляет собой врожденное аутосомно-доминантное заболевание, обусловленное аномалией развития кровеносных капилляров, проявляется мультисистемной сосудистой неоплазией, и, в первую очередь, гемангиобластомами ЦНС и сетчатки. (6,14).
Диагноз болезни Г-Л нередко ставится офтальмологами, так как глазные симптомы возникают раньше других ее проявлений, особенно у детей, и часто бывают единственными(33). Впервые сообщил о семейных случаях ангиоматоза сетчатки и предположил наследственный характер заболевания немецкий офтальмолог Eugen von
Hippel в 1904 г. Этот взгляд был подтвержден шведским неврологом A.V. Lindau, отметившим частое сочетание ангиоматоза сетчатки с аналогичными поражениями мозжечка (18).
Заболевание встречается в популяции в 1 случае на 36 тысяч новорожденных. Болезнь наследуется по аутосомно-доминантному типу, с неполной пенетрантностью, которая составляет – 90%-95%. При данной патологии обнаруживаются мутации в гене VHL (этот ген, являющийся супрессором онкогенов, был выделен в 1993 году), расположенном в коротком плече хромосомы 3 (в локусах p25-р26). Нарушение
2
экспрессии гена VHL ведет к активации и увеличению экспрессии гена VEGF (фактор роста эндотелия сосудов) – онкогена активность которого приводит к повышению риска образования гиперваскуляризованных опухолей. Повреждение гена ведет к развитию онкопатологии не только ЦНС и сетчатки глаза, но и других внутренних органов. При болезни Г-Л могут развиваться карцинома почек и феохромоцитома надпочечников, панкреатические кисты и нейроэндокринные опухоли поджелудочной железы, опухоли перепончатого лабиринта внутреннего уха, опухоли придатков яичка (13,22). Фенотипически проявления болезни Г-Л базируются на различных типах мутаций гена VHL и, как следствие, той или иной степени вероятности развития различных вариантов опухолевого поражения.
Средняя продолжительность жизни больных — 45 лет. Наиболее частые причины смерти — метастазы почечно-клеточной карциномы, неврологические осложнения гемангиобластом ЦНС и феохромацитома надпочечников (14).
Основным методом лечения спинальных ГАБ является оперативный. Вмешательство производится с использованием микрохирургической техники, при этом необходимо стремиться к тотальному удалению опухоли. Парциальное удаление может быть выполнено в случаях профузного кровотечения, что более характерно для крупных экстрадуральных образований. При интрамедуллярных опухолях причиной нерадикального вмешательства могут являться: расположение опухоли на передней поверхности спинного мозга, плотное спаивание с передней спинальной артерией, либо наличие плотных спаек между фрагментами опухоли и спинным мозгом. (1,4). С целью увеличения радикальности удаления гемангиобластом, расположенных преимущественно вентрально, могут быть использованы передние доступы к спинному мозгу (1,29).
Химиотерапия при ГАБ не считается эффективной в связи с нечувствительностью к химиопрепаратам, хотя отдельные сообщения говорят о возможности использования антиангиогенных цитостатиков с целью задержки дальнейшего роста опухоли (28).
Лучевая терапия может быть использована после частичного удаления опухоли или после эмболизации сосудистого русла (с целью предотвращение дальнейшего роста), при рецидивирующем опухолевом росте, при локализации опухоли в труднодоступных для хирургического вмешательства местах, при выраженной васкуляризации ГАБ, в случае тяжелого соматического состояния пациента, препятствующего проведению
3
оперативного вмешательства. При спинальном расположении опухоли возможно использование суммарной дозы — до 30 Гр (15).
По мере внедрения в клиническую практику радиохирургических операций при опухолях спинного мозга появилась возможность использовать для лечения этих пациентов аппараты типа “Gamma-Knife” и “Cyber-Knife”. Использование радиохирургии в перспективе должно стать методом выбора при множественных гемангиобластомах спинного мозга, характерных для болезни Г-Л.
Прогноз при единичных ГАБ после проведения радикальных оперативных вмешательств считается благоприятным. У 85% пациентов оперированных по поводу ГАБ срок выживаемости превышает 5 лет (что в большей степени характерно для интракраниальных субтенториальных опухолей). При болезни Г-Л прогноз обычно неблагоприятный вследствие множественного характера опухолевого поражения (17). Наиболее частой причиной смерти этих пациентов является прогрессирующее течение злокачественных опухолей почки.
Хирургическая тактика при множественных спинальных ГАБ (болезнь Г-Л), вызывающих неврологические расстройства остается предметом дискуссии. По мнению одних авторов возможно поэтапное удаление множественных спинальных опухолей, другие считают что, для этих пациентов методом выбора является радиохирургия (1,27). Хирургическое вмешательство проводится только на тех опухолях, с которыми, по мнению врача, связана максимальная степень выраженности очаговой неврологической симптоматики. К удалению всех спинальных ГАБ, при отсутствии значимого влияния этих опухолей на неврологический статус, стремиться не следует.
До настоящего момента хирургические вмешательства при множественных спинальных ГАБ являются крайне редкими операциями. Ниже представлен случай успешного хирургического и последующего радиохирургического лечения болезни Г-Л с множественными ГАБ продолговатого и спинного мозга.
Пациент Б., 36 лет, поступил в нейрохирургическое отделение клиники нервных болезней ММА им. Сеченова И.М. 25.11.05. При поступлении предъявлял жалобы на слабость в руках, больше справа, невозможность поднять правую руку выше горизонтальной линии; онемение рук и правой ноги, пошатывание при ходьбе, боли в левом подреберье преимущественно ночного характера.
Из анамнеза: с 14-ти лет стал отмечать повышенную утомляемость, сопровождающуюся потливостью и головной болью. В 1996 г. во время медосмотра
4
зафиксировано АД 175/110 мм. рт. ст., тахикардия до 120 уд.в мин. Был направлен на обследование в клинику факультетской терапии ММА, где выявлены опухоли обоих надпочечников. В октябре 1996г пациенту произведено удаление двусторонней феохромоцитомы. После операции находится на постоянной заместительной гормональной терапии (кортинеф, преднизолон). Вскоре после операции у больного появилось пошатывание при ходьбе и онемения правой кисти, которое медленно
нарастало, постепенно присоединилось онемение правой ноги. В 2004г. присоединилось онемение левой кисти, боли в левом подреберье ночного характера. Последние 3 месяца отмечал слабость в руках, преимущественно в правой. Вследствие верхнего парапареза испытывал затруднения в самообслуживании и профессиональной деятельности.
Наследственность у пациента отягощена по материнской линии: у матери в возрасте 23 лет диагностирована 2-сторонняя феохромоцитома. Выполнено удаление опухоли с сохранением надпочечников. Пациент Б. родился от второй беременности, во время которой был выявлен рецидивный рост опухоли с множественным метастазированием. Повторно оперирована сразу после родов. Прошла курс химиотерапии. Через 13 лет возникли жалобы на боли и слабость в ногах, при обследовании в НИИ нейрохирургии выявлена опухоль спинного мозга, которая признана иноперабельной. Спустя 8 месяцев скончалась на фоне нараставших неврологических расстройств.
При поступлении в стационар у пациента в неврологическом статусе : фасцикуляции в языке. Сила в конечностях снижена до 3 баллов в обеих руках и правой ноге. Гипотрофия мышц обеих рук. Тонус диффузно снижен в руках, в ногах четко не изменен. Сухожильно-периостальные рефлексы с рук не вызываются, коленные и ахилловы повышены с 2-х сторон, D>S, зона их расширена. Вызываются патологические рефлексы Бабинского и Россолимо с двух сторон. Клонус обеих стоп. Выражены рефлексы орального автоматизма (хоботковый и нижнечелюстной). Выполнение пальце-носовой и пяточно-коленной проб грубо нарушено в правых конечностях. Неустойчив в позе Ромберга. Походка нарушена по типу сенситивной атаксии. Поверхностная чувствительность снижена в сегментах С6-Th1 и Th8-Th12 с 2- х сторон. Глубокая чувствительность снижена в руках и ногах, больше справа. Боли опоясывающего характера на уровне Th 8 -сегмента слева. Нарушения тазовых функции нет.
5
При МР-томографии головного и спинного мозга обнаружены множественные внутримозговые опухоли (гемангиобластомы), расположенные в продолговатом мозге, шейном и грудном отделах спинного мозга. Образования интенсивно накапливают контрастное вещество. Три крупных образования располагались соответственно: в шейном отделе спинного мозга на уровне С3 позвонка ( 24 х 15мм.), в грудном отделе спинного мозга на уровне Д1-2 позвонков (22 х 12мм.). на уровне Д9 позвонка (диаметр около 11мм.). Мелкие опухоли (диаметром не более 4мм.) располагались в продолговатом мозга и в шейном отделе спинного мозга на уровне С2 позвонка. Выраженная гидромиелия с кистозной трансформацией спинного мозга от уровня С1 до D9 позвонков (рис. 1).
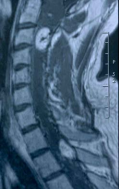
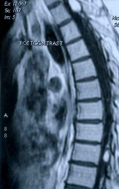
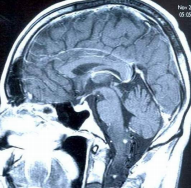
Рис.1а. МР — томограмма головного мозга и верхне-шейных сегментов спинного мозга в сагиттальной плоскости. Т1- взвешенное изображение после контрастирования. Отмечается утолщение продолговатого мозга и понижение интенсивности МР-сигнала от него. В продолговатом мозге и спинном мозге на уровне тела С2-позвонка определяются округлой формы очаги патологического накопления контраста диаметром около 3 мм.
Рис.1б. МР — томограмма шейного и верхне-грудного отделов позвоночника ( от С2 до D3 позвонка) и спинного мозга в сагиттальной плоскости. Т1-взвешенное изображение после проведения контрастного усиления. Определяются 2 объемных образования с четкими контурами, которые интенсивно накапливают контраст. 1-е — интрамедуллярное, распространяющееся от нижнего края тела С2 до верхнего края тела С4 позвонков, размерами 24 х 15 мм, овальной формы; 2-е —
интраэкстрамедуллярное, выходящее на дорзальную поверхность спинного мозга, с распространением от нижнего края тела D1 до нижней трети тела D2 позвонков, неправильной эллипсоидной формы, размерами 22 х 12 мм. На протяжении спинного мозга с уровня тела С2-позвонка и каудальнее определяется зона гипоинтенсивного сигнала – сирингомиелическая полость.
Рис. 1в. МР — томограмма грудного отдела позвоночника (от D 2 до D 10 позвонка) и спинного мозга в сагиттальной плоскости. Т1-взвешенное изображение, после проведения контрастного усиления. Определяются 2 объемных образования с четкими контурами, которые интенсивно накапливают контраст. 1-е — на уровне D1-2 позвонков, описанное выше (рис. 2а), 2-е — интраэкстрамедуллярное, выходящее на дорзальную поверхность спинного мозга, на уровне тела D9-позвонка, неправильной овальной формы с четким ровным контуром, диаметром 11 мм. Между этими новообразованиями также имеется интрамедуллярная зона гипоинтенсивного сигнала — сирингомиелическая полость.
6
Пациенту произведено молекулярно-генетического исследования, в ходе которого выявлен патологический ген VHL в коротком плече хромосомы 3p25, был подтвержден диагноз болезни Г-Л.
В связи с быстро нараставшими в последние месяцы нарушениями самообслуживания и затруднениями в профессиональной деятельности на фоне прогрессирующего снижения силы в руках и атрофии мускулатуры верхних конечностей решено провести удаление крупных гемангиобластом, расположенных на уровне С3 и D1 – 2 позвонков. Показания к проведению операций были связаны с необходимостью стабилизировать процесс в руках в максимально короткие сроки до наступления необратимых двигательных расстройств. Вмешательства планировалось провести на двух уровнях для возможного быстрого регресса гидромиелического поражения шейного отдела спинного мозга.
05.12.05.г. произведена операция: удаления интрамедуллярной опухоли на уровне С3-позвонка. Макроскопические признаки опухоли: красно-оранжевая окраска, частично экстрамедуллярное расположение, патологически расширенные прилежащие сосуды, участки локального гемосидероза в прилежащем веществе мозга полностью соответствовали картине гемангиобластомы (рис.2). Данные патоморфологического
исследования — гемангиобластома.
а) вид операционного поля после 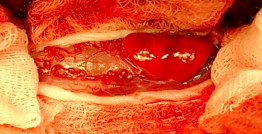
ламинэктомии, вскрытия ТМО и
арахноидальной оболочки:
опухоль красно-оранжевой
окраски, частично
экстрамедуллярного расположения
с прилежащими извитыми,
патологически расширенными
сосудами и участками локального 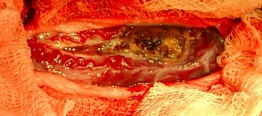
гемосидероза в прилежащем
веществе спинного мозга;
б) вид операционного поля после
удаления опухоли.
Рис 2. Интраоперационные фотографии вмешательства по поводу
гемангиобластомы на уровне D1-2 позвонков:
7
В послеоперационном периоде отмечено незначительное нарастание силы в руках и частичный регресс расстройств поверхностной чувствительности в сегментах С6 –Тh1. 02.03.06г. произведена операция: удаления интрамедуллярной опухоли на уровне D1 – 2 -позвонков. Данные патоморфологического исследования — гемангиобластома. После операции у больного отмечено негрубое нарастание спастики в ногах, которое регрессировало в течение 3 – х месяцев после операции. Расстройства поверхностной чувствительности в руках регрессировали практически полностью. В июле 2006г. на установке “Cyber-Knife” в Германии произведено облучение в режиме радиохирургии мелких гемангиобластом продолговатого мозга, шейного отдела спинного мозга на уровне С2 позвонка и грудного отдела спинного мозга на уровне D9 позвонка. Нарастания неврологических расстройств в ходе проведенных манипуляций и в последующем не отмечалось.
При контрольном обследовании в сентябре 2006г. отмечено нарастание силы в руках до 4 баллов. При МР – исследовании шейного и верхне-грудного отделов спинного мозга отмечен практически полный регресс гидромиелии (рис.3). Больной полностью обслуживает себя, продолжает работать по специальности. Использованная тактика комплексного лечения позволила затормозить прогрессирование неврологических расстройств и добиться частичного регресса неврологических выпадений, что привело к сохранению способности к самообслуживанию и самостоятельной работе. Удаление наиболее крупных опухолей и радиохирургическое воздействие на неудаленные ГАБ позволяет надеяться на получение стойкого функционального результата.
Рис 3. МР — томограмма шейного и 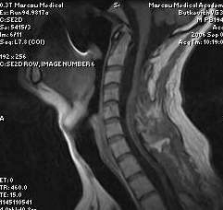
верхне-грудного отделов позвоночника
(от С1 до D3 позвонка) и спинного
мозга в сагиттальной плоскости. Т1-
взвешенное изображение без
контрастирования. Контрольное
исследование выполненное через 9 мес
после первой операции (удаление
гемангиобластомы на уровне С2-4
позвонков) и 6 мес после второй
операции (удаление гемангиобластомы
на уровне D1-2 позвонков). Помимо
отсутствия вышеописанных
новообразований отмечается
практически полный регресс
сирингомиелии.
8
Список литературы
1. Зозуля Ю.А., Слынько Е.И. Спинальные сосудистые опухоли и мальформации., Киев: ЕксОб, 2000, — с.244-266.
2. Леонов М. А., Махмудов У. Б., Шиманский В. Н. Гемангиобластомы центральной нервной системы. Вопросы нейрохирургии (им. Н. Н. Бурденко). — 2003. — №4, с.24-36.
3. Скоромец А.А., Тиссен Т.П., Панюшкин А.И., Скоромец Т.А. Сосудистые заболевания спинного мозга, СПб: Сотис, 1998 – 526 с.
4. Слынько Е.И. Хирургическое лечение сосудистых опухолей позвоночника и спинного мозга. Украинский нейрохирургический журнал. — 2000. — №1(9), с. 36-39.
5. Тиссен Т.П., Окладников Г.И. Ангиографическая диагностика и лечение гемангиобластом спинного мозга и его оболочек. Сборник тезисов всероссийского съезда нейрохирургов. Нижний Новгород – 1998. — с.126.
6. Болезни нервной системы. Руководство для врачей. Под ред. Н.Н.Яхно, М.: Медицина, 2005 — Т.1, с.659-660.
7. Bao-Cheng C., Satoshi T., Kazutoshi H., Matakazu F., Satoru A., Kazuo M.: MR findings in spinal hemangioblastoma: correlation with symptoms and with angiographic and surgical findings // American Journal of Neuroradiology. — 2001. — 1(22). – P. 206-217.
8. Barrey C., Kalamarides M., Polivka M., George B.: Cervical dumbbell intra extradural hemangioblastoma: total removal through the lateral approach: technical case report // Neurosurgery. – 2005. — 56(3). — E625; discussion E625.
9. Berlis A., Schumacher M., Spreer J., Neumann H.P., van Velthoven V.: Subarachnoid haemorrhage due to cervical spinal cord haemangioblastomas in a patient with von Hippel-Lindau disease // Acta Neurochir (Wien). – 2003. — 145(11). – P.1009-1013; discussion 1013.
10. Bertalanffy H., Mennel H.D., Benes L., Riegel T., Aboul-Enein H.: Isolated paramedullary hemangioblastoma originating from the first cervical nerve root: case report // Spine. – 2003. — 15;28(10). — E191-193.
11. Fukushima T., Sakamoto S., Iwaasa M., Hayashi S., Yamamoto M., Utsunomiya H., Tomonaga M.: Intramedullary hemangioblastoma of the medulla oblongata — two case reports and review of the literature // Neurol. Med. Chir. (Tokyo). – 1998. — 38(8). – P.489-498.
12. Huang J.S., Chang C.J., Jeng C.M.: Surgical management of hemangioblastomas of the spinal cord. J. Formos. Med. Assoc. – 2003. — 102(12). – P. 868-875. 13. Jensen RL, Gillespie D, House P, Layfield L, Shelton C.: Endolymphatic sac tumors in patients with and without von Hippel-Lindau disease: the role of genetic mutation, von Hippel-Lindau protein, and hypoxia inducible factor-1alpha expression // J. Neurosurg. – 2004. — 100(3). – P. 488-497.
14. Joerger M, Koeberle D, Neumann HP, Gillessen S.: Von Hippel-Lindau disease – a rare disease important to recognize // Onkologie. – 2005. — 28(3). – P. 159-163.
15. Kato M., Ohe N., Okumura A., Shinoda J., Nomura A., Shuin T., Sakai N.: Hemangioblastomatosis of the central nervous system without von Hippel-Lindau disease: a case report // J. Neurooncol. – 2005. — 72(3). – P. 267-270.
9
16. Konig A., Laas R., Muller D.: Three cases of intramedullary spinal hemangioblastoma: the role of intraoperative histological diagnosis // Neurosurg. Rev. – 1987. – 10. – P. 153-155.
17. Lee DK, Choe WJ, Chung CK, Kim HJ.: Spinal cord hemangioblastoma: surgical strategy and clinical outcome // J. Neurooncol. – 2003. — 61(1). – P. 27-34. 18. Lindau A. Studien uber Kleinhiroysten, Bau, Pathogenese und Bezienhungen zur Angiomatosis retinae. Kobenhavn, 1926.
19. Mahovic Lakusic D, Petravic D, Zurak N, Paladino J, Juric G.: Isolated cervical spinal cord hemangioblastoma — case report. Abstract // Lijec Vjesn. — 2003. — 125(5- 6). – P. 129-131.
20. Mascalchi M., Padovani R., Taiuti R., Quilici N.: Syringomyelia in myotonic dystrophy due to spinal hemangioblastoma // Surg. Neurol. – 1998. — 50(5). – P.446- 448.
21. Minami M., Hanakita J., Suwa H., Suzui H., Fujita K., Nakamura T.: Cervical hemangioblastoma with a past history of subarachnoid hemorrhage // Surg. Neurol. – 1998. – 49(3). – P.278-281.
22. Nakashima H, Tokunaga K, Tamiya T, Matsumoto K, Ohmoto T, Furuta T.: Analysis of spinal cord hemangioblastoma in von Hippel-Lindau disease. Abstract // No Shinkei Geka. – 1999. — 27(6). – P. 533-540.
23. Neumann HP, Lips CJ, Hsia YE, Zbar B.: Von Hippel-Lindau syndrome. Brain Pathol. — 1995. – 5. – P.181-193.
24. Ohtakara K., Kuga Y., Murao K., Kojima T., Taki W., Waga S.: Preoperative embolization of upper cervical cord hemangioblastoma concomitant with venous congestion-case report // Neurol. Med. Chir. (Tokyo). – 2000. — 40(11). – P. 589-593.
25. Omulecka A., Lach B., Alwasiak J., Gregor A.: Immunohistochemical and ultrastructural studies of stromal cells in hemangioblastoma // Folia. Neuropathol. — 1995. — 33. — P. 41-50.
26. Pai S.B., Krishna K.N.: Secondary holocord syringomyelia with spinal hemangioblastoma: a report of two cases // Neurol. India. – 2003. — 51(1). – P. 67-68. 27. Patrice S.J., Sneed P.K., Flickinger J.C., Shrieve D.C., Pollock B.E., Alexander E., Larson D.A., Kondziolka D.S., Gutin P.H., Wara W.M., McDermott M.W., Lunsford L.D., Loeffler J.S. Radiosurgery for hemangioblastoma: results of a multiinstitutional experience // Int. J. Radiat. Oncol. Biol. Phys. — 1996. — 35. — P. 493-499. 28. Piribauer M., Czech T., Dieckmann K., Birner P., Hainfellner J.A., Prayer D., Fazeny-Dorner B., Weinlander G., Marosi C.: Stabilization of a progressive hemangioblastoma under treatment with thalidomide. J. Neurooncol. – 2004. — 66(3). – P. 295-299.
29. Pluta R.M., Iuliano B., DeVroom H.L., Nguyen T., Oldfield E.H.: Comparison of anterior and posterior surgical approaches in the treatment of ventral spinal hemangioblastomas in patients with von Hippel-Lindau disease // J. Neurosurg. – 2003. — 98(1). – P.117-124.
30. Pluta R.M., Wait S.D., Butman J.A., Leppig K.A., Vortmeyer A.O., Oldfield E.H., Lonser R.R.: Sacral hemangioblastoma in a patient with von Hippel-Lindau disease. Case report and review of the literature // Neurosurg Focus. — 2003. — 15;15(2). — E11.
31. Rohde V., Voigt K., Grote E.H.: Intra-extradural hemangioblastoma of the cauda equina // Zentralbl. Neurochir. — 1995. — 56. — P. 78-82.
10
32. Roonprapunt C, Silvera VM, Setton A, Freed D, Epstein FJ, Jallo GI.: Surgical management of isolated hemangioblastomas of the spinal cord // Neurosurgery. — 2001. — 49(2). – P. 321-327; discussion 327-328.
33. Sanfilippo P., Troutbeck R., Vandeleur K.: Retinal angioma associated with von Hippel-Lindau disease // Clin. Exp. Optom. — 2003. – 86(3). – P.187–191. 34. Steinmetz M.P., Claybrooks R., Krishnaney A., Prayson R.A., Benzel E.C.: Surgical management of osseous hemangioblastoma of the thoracic spine: technical case report // Neurosurgery. – 2005. — 57(4 Suppl). — E405; discussion E405. 35. Sumida M., Taguchi H., Eguchi K., Kuroki K., Murakami T., Akimitsu T.: Multiple recurrences of cerebellar hemangioblastoma after 20 years from initial total removal of the tumor. Abstract // No Shinkei Geka. – 2004. — 32(3). – P. 263-26. 36. Tampieri D., Leblanc R., TerBrugge K. Preoperative embolization of brain and spinal hemangioblastomas // Neurosurgery. — 1993. — 33. — P. 502-505. 37. Wu T.C., Guo W.Y., Lirng J.F., Wong T.T., Chang F.C., Luo C.B., Teng M.M., Chang C.Y.: Spinal cord hemangioblastoma with extensive syringomyelia // J. Chin. Med. Assoc.. – 2005. — 68(1). – P. 40-44.
38. Yu J.S., Short M.P., Schumacher J., Chapman P.H., Harsh G.R.: Intramedullary hemorrhage in spinal cord hemangioblastoma. Report of two cases // J. Neurosurg. – 1994. – 81. – P.937-940.

Для отправки комментария необходимо войти на сайт.